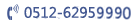主页 > 新闻中心 > 公司新闻 > 关爱男性健康,构建圆满家庭
关爱男性健康,构建圆满家庭

受文化观念和性别意识的影响,男性在家庭和社会中面临着更大的压力,更容易受到不良生活方式的威胁,健康问题更加突出。据统计数据显示,男性的整体健康状况较女性差,如男性比女性的平均寿命短3到5年,男性患恶性肿瘤、心血管疾病等严重疾病的发病率比女性高,男性生殖能力减退已成为世界性的医学和社会问题。
根据中国人口协会 2014 年抽样调查数据显示,中国适婚年龄人群(15-40 岁)总量约为 5.1 亿人,目前我国不孕不育率约为 12.5%~15%,根据保守值测算,国内该群体总量将达到 6400 万。卫计委数据显示,1984 年中国适婚人口不孕不育率仅为 4.8%,至 2012 年已经达到 12.5%,不孕不育患者规模以平均每年增加 80 万人的速度迅速扩大。受工作压力大,长期睡眠不足等因素影响,我国不孕不育人群中男性比例大于女性,且从发生率来看,由男方原因导致的不孕不育约占总体数量的 50%。
男性生殖能力减退原因有很多,其中既包括遗传性的因素,比如基因的突变;也包括环境因素,生活习惯的改变也会导致不孕不育的发生。男性不育还与一些慢性病的发生风险相关。
小编在这里介绍3篇最近与男性不育相关的研究发现,助力男性不育的早期诊断及精准治疗。
男性不育突变基因新发现:人类Piwi基因
Ubiquitination-Deficient Mutations in Human Piwi Cause Male Infertility by Impairing Histone-to-Protamine Exchange during Spermiogenesis
今年5月份发表在Cell的一篇文章,发现人类Piwi基因突变可导致男性不育,并深入揭示了其致病机理。Piwi最早是在果蝇卵巢中被发现的,对干细胞分裂有调控作用,并且能够维持生殖细胞细胞分裂的稳定性,它所编码的PIWI蛋白能够与雄性动物睾丸内的一种小RNA结合,因此,这种小RNA就被称为PiRNA。它俩对生殖细胞基因表达的调控起着非常重要的作用。在高等动物中,Piwi基因的主要活动区域位于雄性的生殖细胞。已有的研究表明,剔除小鼠的Piwi基因将导致雄性不育,而对雌性个体的生育能力则无明显影响。在人类男性的睾丸组织中,“活跃”存在着Piwi基因家族的4种蛋白质产物,但迄今为止,这些蛋白质在人类精子形成中的功能及作用机制还未见任何报道,研究人员对Piwi基因突变在男性不育症发生中的作用也几乎一无所知。

这项研究工作是一项从人类遗传学到动物模型、分子机理及治疗策略探索的系统研究,代表了遗传学研究的新高度及新深度。研究对象被锁定在一种名为Hiwi的人类Piwi基因上,经过筛查413例患有无精、弱精症的临床病例,发现其中3例患者该基因中的关键元件——“D-box”(控制HIWI蛋白泛素化修饰降解的关键元件)发生了突变。
研究人员通过动物实验进一步证实,携带该基因突变的雄性小鼠均不能繁育后代,尽管它们仍能产生少量精子,但这部分精子形态异常、头部结构疏松、无活力,其疾病表型与患者完全一致。通过对患者亲属进行的基因检测发现,该类突变可来源于个体基因自发变异,也可由母亲遗传获得。
因为D-box突变导致精子细胞中的Miwi蛋白(小鼠模型Piwi基因表达的产物)没有被降解,而Miwi蛋白可以和RNF8(组蛋白泛素连接酶)结合,结合后RNF8就无法按照“原定计划”进入细胞核,介导H2A和H2B组蛋白的泛素化修饰,导致小鼠的精子大都是畸形的了。
最后,研究人员想有没有什么办法能阻止这一“悲剧”的发生呢?于是他们尝试了将能和Miwi蛋白结合的,RNF8上的一段RNF8-N肽用载体转进了小鼠体内。结果显示,RNF8-N肽顺利地与精子中“滞留”的Miwi蛋白结合,而其余的RNF8就“逃过一劫”,像正常发育时一样进入了精子细胞核中,由此产生的精子形态恢复了正常,而且研究人员还观察到了它们能正常地“游动”。也就是说,这种方法“拯救”了无精症小鼠。
总的来说,这项研究为我们揭示了由Piwi基因突变到精子异常型不育的“蝴蝶效应”,而且还验证了一种“干预手段”,尽管这一手段还只是在小鼠体内适用。我们也希望研究能早日进入临床,造福广大有困扰的夫妻!
线粒体DNA突变导致的男性不育有望被治愈
Increased Total mtDNA Copy Number Cures Male Infertility Despite Unaltered mtDNA Mutation Load
8月1日,发表在 Cell Metabolism上的这篇研究中,德国Max Planck研究所的科学家证实,增加线粒体中的总DNA数量能够修复不育小鼠的睾丸功能和精子质量。
mtDNA mutations cause male infertility due to loss of spermatocytes and spermatids
Absolute levels of wild-type mtDNA, not the mutation load, determine the phenotype
Pathophysiological responses to mtDNA mutations worsen the infertility phenotype
Absolute levels of wild-type mtDNA, not the mutation load, determine the phenotype
Pathophysiological responses to mtDNA mutations worsen the infertility phenotype
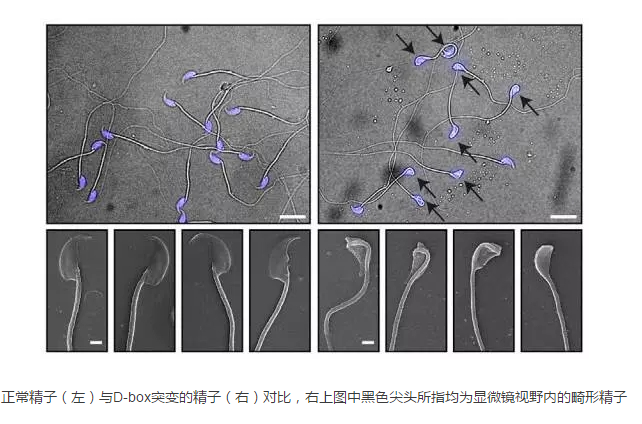
在这一研究中,研究小组调查了mtDNA拷贝数的变化将如何影响异质性(heteroplasmic)mtDNA突变的表型表现(phenotypic manifestations)。通过对小鼠进行研究,科学家们找到了一种方法来克服mtDNA突变带来的后果。mtDNA大量突变的小鼠是不育的,拥有较少的、活力更差的精子。人类研究表明,mtDNA点突变和缺失与精子质量呈负相关。
该研究的第一作者Min Jiang说:“我们增加了睾丸线粒体mtDNA的总数量。这并没有改变突变mtDNA的比例,但是增加了非突变mtDNA的相对数量(上图)。最终,我们证实,这种途径修复了线粒体的能量产生以及精子的质量。”
研究小组接下来准备筛选能够刺激睾丸中总mtDNA数量的药物。希望能够找到一种有效的策略,用以治疗由mtDNA突变引发的不育患者。如果这项研究技术能够成功运用到临床治疗男性不育上来,必能造福于人类,这样愈来愈多的男性不育症患者将有希望治愈。
男性不育最主要的原因:Klinefelter综合征(XXY)也能生育正常宝宝
研究小组接下来准备筛选能够刺激睾丸中总mtDNA数量的药物。希望能够找到一种有效的策略,用以治疗由mtDNA突变引发的不育患者。如果这项研究技术能够成功运用到临床治疗男性不育上来,必能造福于人类,这样愈来愈多的男性不育症患者将有希望治愈。
男性不育最主要的原因:Klinefelter综合征(XXY)也能生育正常宝宝
Fertile offspring from sterile sex chromosome trisomic mice
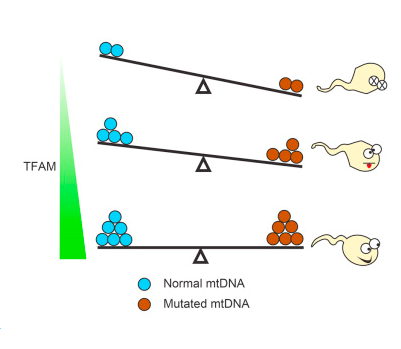
8月17日发表在Science上的一篇研究文章中,英国FrancisCrick研究所和日本京都大学的科学家们合作发现了一种去除多余的性染色体来繁殖后代的方法。如果该发现可以安全地转移到人类,它最终可能让Klinefelter综合征(XXY)或双Y综合征(XYY)的男性不孕患者通过辅助生殖使用这种技术生育孩子。
研究团队从XXY和XYY小鼠获取耳朵的组织进行培养,收集称为成纤维细胞的结缔组织细胞。他们将成纤维细胞转化为干细胞,并注意到在这个过程中,一些细胞失去了额外的性染色体。这种现象研究人员称为三体偏倚染色体丢失(trisomy-biased chromosome loss,TCL)。用已有的方法,他们使用特定的化学信号来诱导iPSC(诱导性多功能干细胞)分化成男性生殖细胞谱系。这些细胞进入宿主小鼠的睾丸后发育成成熟精子。然后,研究人员利用成熟的精子,通过辅助生殖,培育出健康、可育的后代。
研究团队从XXY和XYY小鼠获取耳朵的组织进行培养,收集称为成纤维细胞的结缔组织细胞。他们将成纤维细胞转化为干细胞,并注意到在这个过程中,一些细胞失去了额外的性染色体。这种现象研究人员称为三体偏倚染色体丢失(trisomy-biased chromosome loss,TCL)。用已有的方法,他们使用特定的化学信号来诱导iPSC(诱导性多功能干细胞)分化成男性生殖细胞谱系。这些细胞进入宿主小鼠的睾丸后发育成成熟精子。然后,研究人员利用成熟的精子,通过辅助生殖,培育出健康、可育的后代。
然而,在这种方法可以应用于人类之前,还需要进行更多的研究。研究人员称目前还没有办法在人体外形成成熟的精子。在小鼠实验中,研究者必须将可能成为精子的细胞注射回到睾丸中,帮助它们完成发育。但是发现这一操作导致了一些小鼠受试对象的肿瘤细胞产生。因此,在考虑用到人类之前,一个必须克服的问题即必须减少肿瘤形成。
引起男性不育的原因中,遗传因素占30%,包括染色体异常,单基因异常,多因素异常,线粒体DNA突变以及遗传性的内分泌失调,以上新的研究也给各种遗传原因的男性不育带来了治愈的希望。
医疗技术的发展,让想要宝宝的家庭,通过人工干预,为家庭增添希望,但往往病不对症导致失败。天昊男性不育试剂盒覆盖位点全面,有助于增进对男性不育症的了解,以及研究更好的诊断和治疗方法。最后祝各位男性节日快乐,保障健康,构建美好家庭!
****************************************************************************************************************
参考文献:
1. Gou L T, Kang J Y, Dai P, et al. Ubiquitination-Deficient Mutations in Human Piwi Cause Male Infertility by Impairing Histone-to-Protamine Exchange during Spermiogenesis[J]. Cell, 2017.
2. Jiang M, Kauppila T E S, Motori E, et al. Increased Total mtDNA Copy Number Cures Male Infertility Despite Unaltered mtDNA Mutation Load[J]. Cell Metabolism, 2017, 26(2): 429-436. e4.
3. Hirota T, Ohta H, Powell B E, et al. Fertile offspring from sterile sex chromosome trisomic mice[J]. Science, 2017, 357(6354): 932-935.